 CRONACA – Allo stato attuale della ricerca scientifica, in quasi tutti gli ambiti non siamo ancora in grado di rinunciare alla sperimentazione animale, sostituendola con modelli in vitro (ovvero in provetta) o in silico (ovvero simulazioni matematiche effettuate al computer). Tuttavia queste tecniche possono affiancare la sperimentazione in vivo sugli animali, e parte dell’impegno dell’Unione Europea in tale ambito si riflette nell’attività di EURL ECVAM, European Union reference laboratory for alternatives to animal testing, dove vengono studiati e validati i metodi alternativi alla sperimentazione animale.
CRONACA – Allo stato attuale della ricerca scientifica, in quasi tutti gli ambiti non siamo ancora in grado di rinunciare alla sperimentazione animale, sostituendola con modelli in vitro (ovvero in provetta) o in silico (ovvero simulazioni matematiche effettuate al computer). Tuttavia queste tecniche possono affiancare la sperimentazione in vivo sugli animali, e parte dell’impegno dell’Unione Europea in tale ambito si riflette nell’attività di EURL ECVAM, European Union reference laboratory for alternatives to animal testing, dove vengono studiati e validati i metodi alternativi alla sperimentazione animale.
Come si può leggere sul sito EURL ECVAM, al momento si dispone di metodi alternativi che sostituiscono completamente la sperimentazione animale per i seguenti effetti tossicologici: irritazione cutanea, corrosività cutanea, assorbimento/penetrazione dermica e fototossicità. Dopo aver approfondito i limiti e le possibilità dei test in vitro e in silico, con i ricercatori del team EURL ECVAM abbiamo approfondito il funzionamento di questi metodi alternativi, uno per uno.
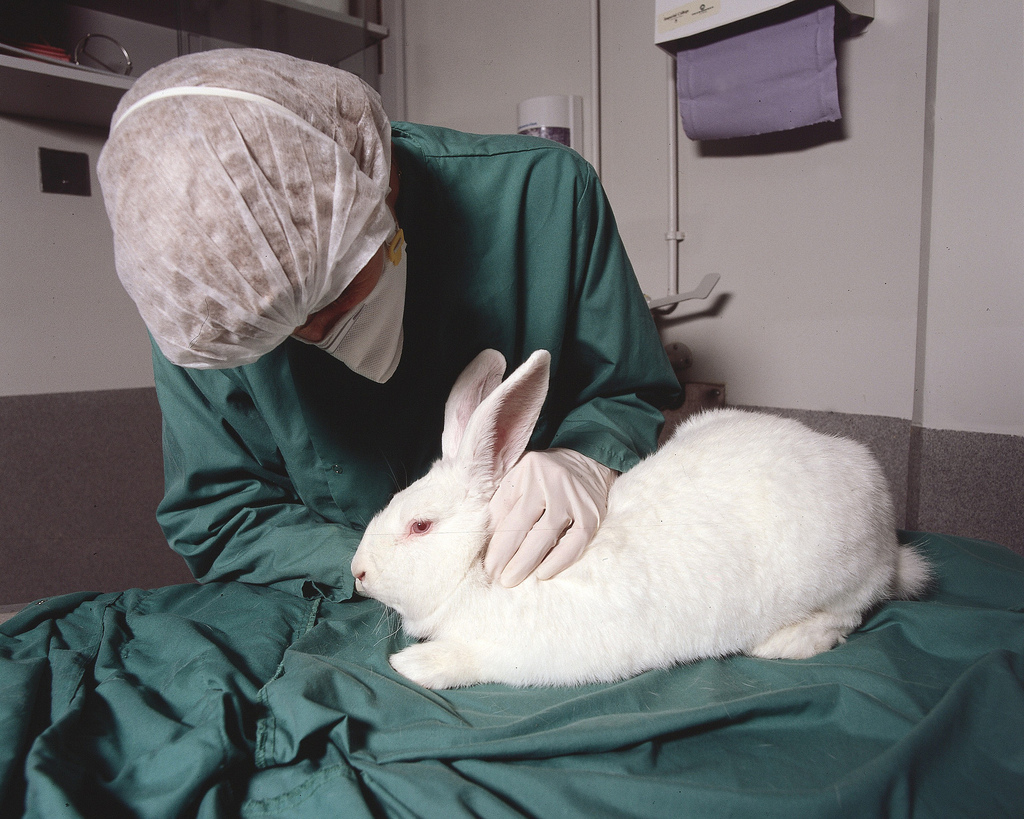
I metodi in vitro per l’irritazione cutanea, spiegano gli scienziati, utilizzano come sistema di test l’epidermide umana ricostruita (un modello in 3D), e come effetto tossicologico la citotossicità/vitalità dei tessuti. I tessuti vengono ricostituiti utilizzando cheratinociti umani, la tipologia di cellule più diffusa dell’epidermide, usualmente prelevati da campioni di donatori consenzienti durante le operazioni di chirurgia plastica, oppure dal prepuzio umano. Questi metodi sono già stati adottati dall’OCSE (Organizzazione per la cooperazione e lo sviluppo economico) e dall’UE e, insieme ai metodi in vitro per la corrosione cutanea, sono considerati completamente sostitutivi del test in vivo denominato ‘Draize test’ che viene tipicamente praticato sui conigli per valutare l’irritabilità di occhi e pelle. Sono entrambi già ampiamente usati in Europa e nei paesi extraeuropei.
Anche per lo studio della corrosione cutanea, dunque, esistono tre diversi tipi di metodi in vitro validati da EURL ECVAM. Il primo è anch’esso basato su epidermide umana ricostruita e citotossicità/vitalità dei tessuti, come nel caso dei metodi per l’irritazione cutanea appena analizzati. Il secondo tipo invece è un test in vitro effettuato su bio-barriera, ovvero su membrana biologica, ed è noto come CORROSITEX: utilizza come sistema di test una matrice di collagene idratato che simula la pelle, misurando il tempo necessario a una sostanza chimica per oltrepassare la matrice e la membrana di filtro che la supporta. Il terzo metodo è invece il saggio di resistenza elettrica transcutanea (TER), che utilizza pelle di ratto come sistema di test e analizza direttamente l’integrità e la funzione di barriera del tessuto cutaneo misurandone la resistenza elettrica.
Rispetto agli altri metodi, il TER ha lo svantaggio di non essere in grado di distinguere le sostanze chimiche in base al potenziale corrosivo, che può variare di molto da una all’altra. Inoltre nell’effettuare il test si sacrificano animali (per la pelle) e, come spiegano i ricercatori, in alcuni paesi il metodo potrebbe essere considerato come un esperimento animale in vivo; si rende infatti necessario rasare, lavare e trattare gli animali con antibiotico per un periodo che va dai 4 ai 6 giorni prima di utilizzarli. Se impiegati insieme ai metodi in vitro per l’irritazione cutanea, tuttavia, tutti e tre sono considerati completamente sostitutivi del ‘Draize test’.
Il metodo in vitro già validato per l’assorbimento e la penetrazione cutanea misura invece la diffusione, e il metabolismo cutaneo, delle sostanze chimiche nella (e attraverso la) pelle verso un fluido ricevitore. Si può utilizzare sia pelle di provenienza umana che animale, e malgrado questo metodo in vitro non sia mai stato formalmente convalidato, nel 1999 gli esperti dell’OCSE concordarono che i dati disponibili erano sufficienti a sostenerne l’accettazione. Questo metodo può essere considerato come una completa sostituzione del test in vivo per numerose applicazioni, ed è già ampiamente usato in Europa e nei paesi extraeuropei.
Per quanto riguarda la fototossicità invece (ovvero quelle sostanze che esposte alla luce diventano tossiche), il metodo in vitro convalidato da EURL ECVAM utilizza come sistema di test dei fibroblasti embrionali di topo adattati alla crescita in vitro, ovvero immortalizzati in modo da poter sopravvivere molto a lungo da ibernati. In questo modo una sostanza chimica sottoposta a test viene considerata fototossica se, unita all’irradiazione con raggi UV, inibisce la capacità dei fibroblasti di captare il colorante vitale ‘rosso neutro’. Il test, tuttavia, è noto per produrre una percentuale insolitamente elevata di risultati positivi nei farmaci per uso non topico (che non vengono applicati direttamente sulla parte malata). Questo inconveniente può essere superato utilizzando un metodo di test basato su epidermide umana ricostruita, che tuttavia non è ancora stato adottato dall’OCSE.
Siamo dunque ancora lontani dall’essere in grado di abbandonare la sperimentazione animale, per affidarci completamente a test in vitro e in silico. Ma quanto si sta impegnando l’UE nel finanziare le attività di ricerca per sviluppare e validare questi metodi alternativi? Come spiega il team EURL ECVAM, nel periodo 2007 – 2011 la Commissione europea ha messo a disposizione circa 238 milioni di euro per la ricerca in questo campo. La maggior parte di questi finanziamenti (circa 198 milioni) è andata a progetti del Sesto e Settimo Programma Quadro. Anche l’industria cosmetica contribuisce attivamente allo sviluppo di metodi alternativi: un esempio concreto è l’iniziativa SEURAT-1 (Safety Evaluation Ultimately Replacing Animal Testing) nel campo della tossicità per dose ripetuta. Questo progetto è finanziato congiuntamente dalla Commissione europea e dall’industria cosmetica, ciascuna delle parti con un contributo di 25 milioni di euro nel periodo 2011 – 2015.
Crediti immagine: Understanding Animal Research, Flickr