Neurone o astrocita? Il destino della cellula nervosa è deciso da Foxg1
Foxg1 è un coordinatore nella neuroembriogenesi. È questo gene a stabilire se i precursori delle cellule diventeranno neuroni oppure astrociti.
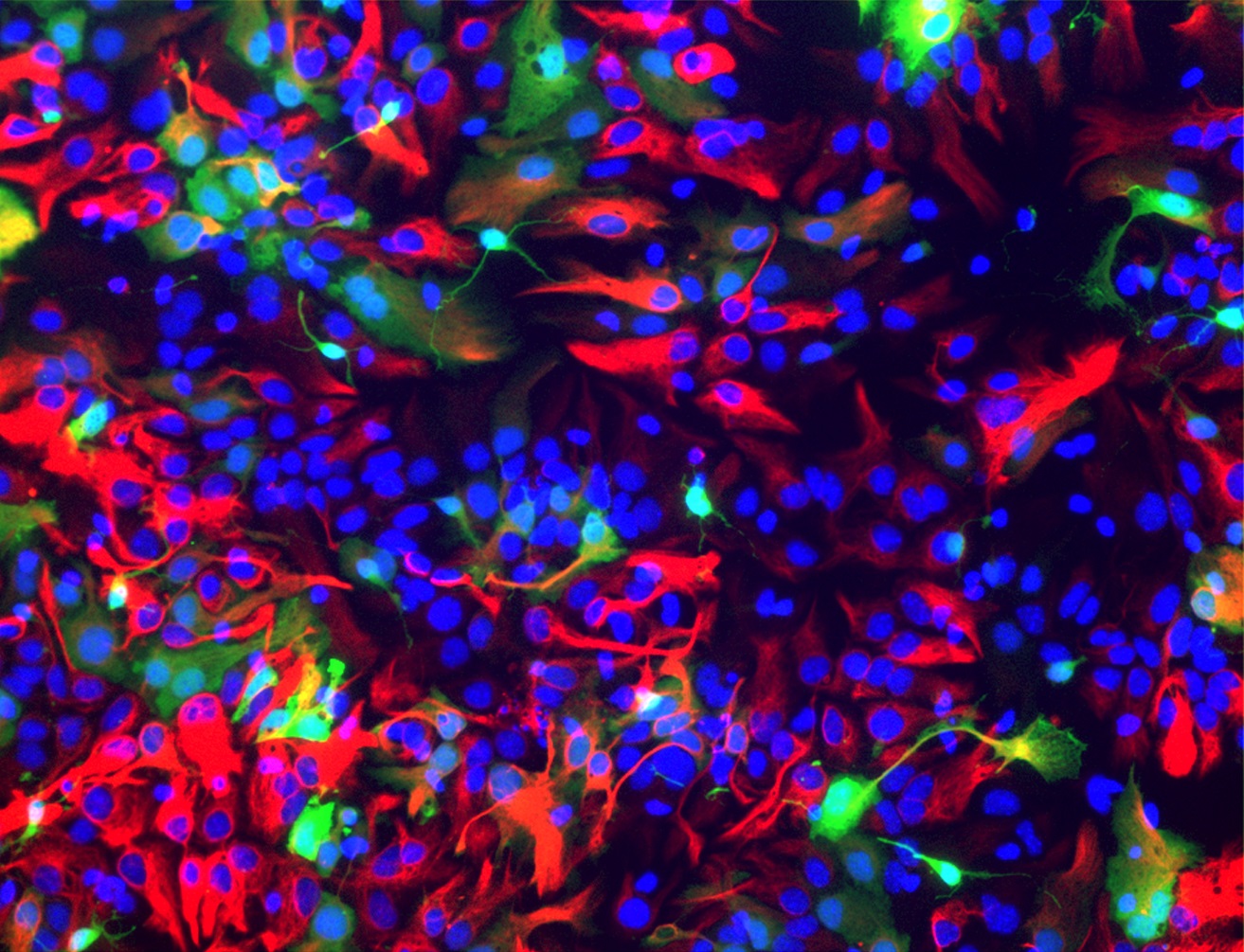
Oltre ai neuroni, nel nostro cervello sono presenti in altissimo numero anche altri tipi cellulari, che potremmo definire di supporto, che vanno sotto la nomenclatura generale di cellule gliali. Tra queste, tra le più importanti per il corretto funzionamento del sistema nervoso, vi sono gli astrociti. Neuroni e astrociti derivano però dallo stesso precursore staminale, e fino a pochi mesi fa non era chiaro quali fossero i meccanismi molecolari che decidono il destino che deve intraprendere il precursore. Un recente studio di un’equipe della SISSA (Scuola Internazionale Superiore di Studi Avanzati) di Trieste sembra aver identificato il responsabile di questa decisione cruciale: il gene Foxg1.
Un gene – e una proteina – dai tanti ruoli
Foxg1 è un gene che codifica per una proteina che è a sua volta un fattore di trascrizione, ossia aiuta a regolare l’attività di altri geni. Per questo è cruciale già dalle prime fasi dello sviluppo embrionale, come spiega a OggiScienza Antonello Mallamaci, direttore del Laboratorio di Sviluppo Corticale della SISSA che ha coordinato la ricerca.
“FOXG1 è acceso nel cervello molto presto, in realtà ben prima che ci sia un cervello definibile in quanto tale: serve infatti, innanzitutto, per marcare il luogo in cui si formerà la porzione anteriore del cervello, in particolare la corteccia cerebrale, istruendo le cellule staminali a creare quella struttura e non altre. Dopo che sono state prese queste decisioni così basilari, il gene continua a essere acceso nei cosiddetti progenitori commissionati: cellule neurali che ancora proliferano ma che si sono specializzate a produrre determinati tipi di cellule neurali”.
Il gruppo di ricerca è al lavora su questo gene da quasi 15 anni e nel 2010 ha pubblicato un primo studio, sulla rivista Stem Cells, in cui si ipotizzava un ruolo più specifico di Foxg1 nella delicata transizione da neurogenesi ad astrogenesi. “La produzione degli astrociti è infatti temporizzata, fa seguito alla produzione di neuroni, e questa sequenza è fondamentale affinché i circuiti neurali si sviluppino correttamente. C’è una fase iniziale in cui predomina la produzione di neuroni, poi a mano a mano che questa cala si osserva un graduale aumento della produzione di astrociti”, conferma Mallamaci.
A coordinare questo processo c’è un numero sparuto di geni, a loro volta regolati dall’attività di Foxg1 – che agisce come una sorta di freno generale dall’apparato di neuroembriogenesi -. “A monte, Foxg1 dice alle cellule neurali staminali di ridurre la transizione a neuroni a favore del progenitore astroblastico. Poi, una volta che l’astroblasto è prodotto, Foxg1 rallenta ulteriormente la maturazione dell’astroblasto ad astrociti maturi”.
Tanti esperimenti, tante tecniche all’avanguardia
L’identificazione di questo ruolo coordinatore ha richiesto molti esperimenti, ciascuno caratterizzato da una tecnica specifica. Lo studio è frutto del lavoro di oltre quattro anni da parte di studentesse e studenti di Dottorato, come sottolinea Mallamaci. “Persone brillanti, piene di entusiasmo e di iniziativa, che non hanno semplicemente ‘eseguito gli ordini’ impartiti dal responsabile, ma che hanno dato molto in termini di ideazione e progettazione del progetto”.
Tutti i fenomeni descritti nello studio, pubblicato sulle pagine della rivista Cerebral Cortex, sono stati validati in vivo nelle finestre temporali appropriate e prestando una particolare attenzione ai livelli quantitativi di espressione del gene. “Non abbiamo fatto un semplice on-off ma piccole, delicate modificazioni dell’espressione del gene, del tutto paragonabili a quelle osservabili in natura. Per fare ciò abbiamo preparato delle colture primarie di precursori che deriviamo da degli embrioni di topo; poi tali colture sono state ingegnerizzate utilizzando dei vettori lentivirali, che permettono appunto di agire sul gene con altissima flessibilità e raffinatezza”.
Una volta “truccati” con i vettori lentivirali e marcati, è possibile studiare il destino a cui vanno incontro i progenitori neurali ri-trasferendoli nell’animale in maniera omotopica – cioè nella stessa zona in cui queste cellule normalmente si sviluppano – e isocronica – ossia in contesto temporalmente coerente con il normale neurosviluppo -.
Come quantificare, però, l’espressione di un particolare gene e delle proteine da esso prodotte? È a questo punto che entra in gioco l’IRCCS Burlo Garofolo di Trieste, il cui team di genetisti collabora ormai da diversi anni con il gruppo di ricerca della SISSA. “Una collaborazione che nasce dall’esperienza maturata presso i Laboratori di Diagnostica Avanzata Traslazionale dell’Istituto nel campo della citofluorimetria”, spiega a OggiScienza Erica Valencic, ricercatrice del Burlo Garofolo coinvolta nel progetto. “Questa tecnica permette di valutare, dal punto di vista qualitativo e quantitativo, l’effetto di modifiche effettuate sulle cellule, ad esempio in seguito all’introduzione al loro interno di nuovi geni”.
La lunga strada verso una possibile applicazione clinica
Questo studio ha permesso quindi di capire cosa succede nel cervello di topo – ma anche, analogamente, in quello dell’essere umano, con il quale il roditore condivide questo complicato apparato genetico – nella normale embriogenesi, ma c’è anche una parte del laboratorio diretto da Mallamaci che lavora su dei modellidi malattia, volti ad identificare cosa “va storto” quando c’è una mutazione di Foxg1. Succede nel caso di alcune patologie genetiche rare. “Una riduzione dell’attività di Foxg1 causa una delle varianti genetiche della Sindrome di Rett, caratterizzata da un grave ritardo psicomotorio. Al contrario, una sua aumentata attività è responsabile di una rara forma di epilessia associata a ritardo psicomotorio (la Sindrome di West)”, spiega Valencic.
Quello che si sa, però, è ancora poco, e manca ancora molta strada per sperare di poter fare qualcosa che sia utile per il trattamento di queste patologie sull’essere umano. Anche in questo senso la manipolazione delicata, finemente regolata, sarà fondamentale, quindi in un certo senso quello che si sta facendo è ‘affinare le armi’.
“Appunto perché FOXG1 è un gene che ha molteplici funzioni, bisogna andare ad agire nel momento giusto e nel posto giusto, altrimenti si rischiano di fare grossi danni, quasi peggiori della malattia”, sottolineaMallamaci. La ricerca quindi è ancora lunga, ma “anche se è vero che le ricadute terapeutiche di questa scoperta sono molto lontane, le conoscenze derivate da questo studio serviranno a capire meglio altre malattie del neurosviluppo, al momento orfane di cure” conclude Valencic.
Leggi anche: Le neuroscienze cognitive incontrano le intelligenze artificiali
Articolo pubblicato con licenza Creative Commons Attribuzione-Non opere derivate 2.5 Italia. ![]()





