 STORIA – I britannici ci vedono un plumcake, i francesi un far bretone. In Italia, invece, dicono abbia una spiccata somiglianza con un panettone. Comunque lo si veda, il primo modello dell’atomo descritto dal britannico Joseph John Thomson (1856-1940) sembra sbizzarrire l’interesse degli appassionati di pasticceria. E a ragione: perché difficilmente si sarebbero trovati esempi migliori per illustrare un modello composto da un certo numero di elettroni (l’uvetta) spazialmente localizzati, immersi in una distribuzione di carica positiva diffusa (l’impasto lievitato).
STORIA – I britannici ci vedono un plumcake, i francesi un far bretone. In Italia, invece, dicono abbia una spiccata somiglianza con un panettone. Comunque lo si veda, il primo modello dell’atomo descritto dal britannico Joseph John Thomson (1856-1940) sembra sbizzarrire l’interesse degli appassionati di pasticceria. E a ragione: perché difficilmente si sarebbero trovati esempi migliori per illustrare un modello composto da un certo numero di elettroni (l’uvetta) spazialmente localizzati, immersi in una distribuzione di carica positiva diffusa (l’impasto lievitato).
La formulazione del modello a panettone del 1904 seguiva la scoperta, sette anni prima, dell’elettrone, sempre a opera di Thomson. Con quella scoperta si capì che la materia era formata di due parti: una negativa, gli elettroni appunto, e l’altra positiva. Come fosse però organizzata quest’ultima, restava ignoto: la scoperta del nucleo avvenne infatti successivamente all’ideazione del modello di Thomson. Quest’ultimo resistette fino al 1909, anno in cui, con l’esperimento di Geiger-Marsden diretto dal fisico neozelandese di nascita e britannico di adozione Ernest Rutherford (1871-1937), fu scoperta l’esistenza del nucleo atomico.
 Attorno al 1900, infatti, si iniziò a pensare che gli atomi fossero sfere permeabili. Nel 1909 Rutherford, con la collaborazione di Hans Geiger e Ernest Marsden, sottopose a verifica questa teoria con l’esperimento, oggi famosissimo, della lamina d’oro. L’esperimento era semplice: una sorgente radioattiva avrebbe sparato un fascio di particelle alfa, ognuna formata da due protoni e due neutroni (al tempo ci si sarebbe espressi diversamente, dal momento che il neutrone fu scoperto soltanto una ventina d’anni dopo, nel 1932) contro una sottilissima lamina d’oro. Attorno alla lamina d’oro era stato disposto uno schermo ricoperto di solfuro di zinco, in modo che le particelle alfa, colpendo lo schermo, lasciassero tracce microscopiche nel solfuro di zinco.
Attorno al 1900, infatti, si iniziò a pensare che gli atomi fossero sfere permeabili. Nel 1909 Rutherford, con la collaborazione di Hans Geiger e Ernest Marsden, sottopose a verifica questa teoria con l’esperimento, oggi famosissimo, della lamina d’oro. L’esperimento era semplice: una sorgente radioattiva avrebbe sparato un fascio di particelle alfa, ognuna formata da due protoni e due neutroni (al tempo ci si sarebbe espressi diversamente, dal momento che il neutrone fu scoperto soltanto una ventina d’anni dopo, nel 1932) contro una sottilissima lamina d’oro. Attorno alla lamina d’oro era stato disposto uno schermo ricoperto di solfuro di zinco, in modo che le particelle alfa, colpendo lo schermo, lasciassero tracce microscopiche nel solfuro di zinco.
Lo scopo dell’esperimento era trovare prove a favore della teoria secondo cui gli atomi sono sfere permeabili neutre. Ci si aspettava che le particelle alfa, dotate di alta energia, non avessero problemi a sfrecciare attraversando qualche atomo: esse avrebbero dovuto semplicemente passare dritte attraverso la lamina d’oro e lasciare delle tracce in una piccola regione dello schermo posto dietro la lamina. In realtà, lo schermo mostrava tracce nella parte dietro la lamina ma, sorprendentemente, ne mostrava alcune anche nella parte di fronte alla lamina.
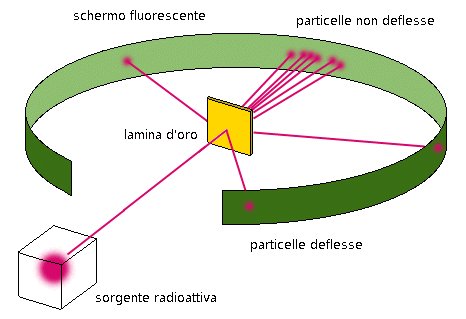 Rutherford interpretò così i risultati dell’esperimento: la maggior parte delle particelle alfa erano passate senza problemi attraverso le regioni più esterne degli atomi, e le particelle alfa restanti dovevano aver rimbalzato contro qualcosa, dentro gli atomi, che fosse piccolo, denso e di carica positiva. Anche se ciò sconfessava la sua ipotesi che gli atomi fossero sfere permeabili, gli forniva elementi per una nuova ipotesi: che l’atomo avesse un nucleo. Questo nuovo modello spiegava i suoi risultati, e non solo: è stato una chiave di volta per lo sviluppo della moderna teoria atomica.
Rutherford interpretò così i risultati dell’esperimento: la maggior parte delle particelle alfa erano passate senza problemi attraverso le regioni più esterne degli atomi, e le particelle alfa restanti dovevano aver rimbalzato contro qualcosa, dentro gli atomi, che fosse piccolo, denso e di carica positiva. Anche se ciò sconfessava la sua ipotesi che gli atomi fossero sfere permeabili, gli forniva elementi per una nuova ipotesi: che l’atomo avesse un nucleo. Questo nuovo modello spiegava i suoi risultati, e non solo: è stato una chiave di volta per lo sviluppo della moderna teoria atomica.
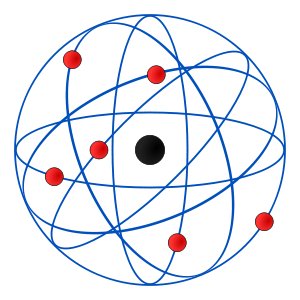
I risultati dell’esperimento del 1909 furono analizzati nei due anni successivi e, nel 1911, esattamente cent’anni fa, Rutherford pubblicò un articolo in cui formulava un nuovo modello, che prese il nome di “modello planetario”. Come nel modello planetario vero e proprio a cui si riferiva, infatti, anche quello atomico prevedeva una carica positiva centrale concentrata in un volume ridotto (il “Sole” del sistema) e, a distanze considerevoli, minuscole cariche negative che vi orbitavano intorno (come i pianeti orbitano intorno al Sole) seguendo traiettorie ben precise. Ecco perché ancora oggi l’atomo viene rappresentato secondo il modello di Rutherford, per esempio nella bandiera dell’AIEA.
Eppure, quel modello non vale più. O, per meglio dire, vale soltanto parzialmente. Già perché, se con il modello di Rutherford venivano risolte alcune delle questioni lasciate insolute dal “panettone” di Thomson, se ne aprivano altre, nuove. Per esempio, il modello planetario non andava per niente d’accordo con la teoria elettromagnetica della fisica classica: gli elettroni di Rutherford avrebbero dovuto emettere, orbitando attorno al nucleo, energia sotto forma di radiazione elettromagnetica, e di conseguenza spiraleggiare elegantemente fino a schiantarsi nel nucleo stesso. Ma ciò non accadeva. Fu soltanto con la meccanica quantistica, soprattutto con gli studi di Niels Bohr (1885-1962) prima, che di Rutherford era stato allievo, e con quelli di Werner Heisenberg (1901-1976) ed Erwin Schrödinger (1887-1961) poi, che si arrivò alla conclusione che non si poteva parlare di orbite né di traiettorie per gli elettroni, ma soltanto di probabilità di trovare un elettrone in un certo punto dello spazio.
Insomma, dal modello planetario sparivano non solo le orbite, ma anche gli elettroni intesi come oggetti identificabili singolarmente a un dato tempo e in un dato spazio. Gli elettroni formavano invece, secondo gli studi di inizio XX secolo, una nuvola che circondava il nucleo: un’entità, piuttosto che un insieme di unità. Ma la rappresentazione dell’atomo Rutherford è ormai entrata nella storia, e ci sono pochi dubbi sul fatto che neppure i prossimi centenari degli studi di Bohr e colleghi riusciranno a scalfire l’immagine a cerchi e sfere del suo modello.





