Due ricerche pubblicate contemporaneamente su Current Biology e Cell dimostrano i passi avanti fatti per lo sviluppo di una possibile cura della malattia di Huntington. Per il momento solo su modelli animali.
Due ricerche pubblicate contemporaneamente su Current Biology e Cell dimostrano i passi avanti fatti per lo sviluppo di una possibile cura della malattia di Huntington. Per il momento solo su modelli animali.
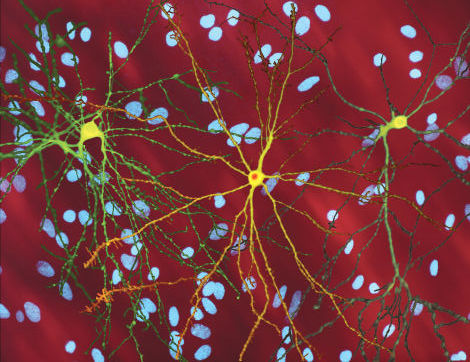
Quanto può essere utile un piccolo moscerino della frutta? Tantissimo se viene usato come modello animale nei laboratori di ricerca. E ieri ne abbiamo avuto l’ennesima conferma, con l’uscita dell’articolo di Flaviano Giorgini e Charalambos Kyriacou sulla rivista Current Biology. I ricercatori del Dipartimento di genetica dell’Università di Leicester hanno osservato che sia l’inibizione genetica sia quella farmacologica della chineurina 3-monoossigenasi (KMO) riducono la neurodegenerazione nella Drosophila melanogaster.
La KMO è un enzima coinvolto nella via della chinurenina, che è responsabile della degradazione del triptofano. Numerosi metaboliti prodotti in questo percorso sono neuroattivi, in grado cioè di modulare la neurodegenerazione. Si è visto che la KMO si trova in un punto critico di questo percorso e la sua inibizione porta ad un aumento dei metaboliti neuroprotettivi, importanti per la prevenzione della neurodegenerazione delle cellule in malattie come quella di Huntington o l’Alzheimer.
La malattia di Huntington è una devastante malattia ereditaria neurodegenerativa che è sempre fatale. Il disordine del sistema nervoso centrale provoca la progressiva perdita delle cellule del cervello, riducendo lentamente la capacità di una persona di camminare, pensare e parlare. La malattia di Huntington è rara e colpisce 1 persona ogni 100mila, manifestando i primi sintomi intorno ai 35 anni e portando all’invalidità totale in circa 20 anni. La scoperta del gene responsabile di questa malattia risale al 1993, quando in un articolo pubblicato sulla rivista Cell è stata dimostrata la mutazione del gene dell’huntingtina.
“Abbiamo deciso di concentrare le nostre ricerche sul gene della KMO grazie a precedenti esperimenti fatti su alcuni lieviti che mimavano la malattia di Huntington” ha spiegato Flaviano Giorgini a Oggi Scienza. Il genetista ci ha raccontato che la soppressione del gene che codifica per la KMO è protettiva in queste cellule e “Così abbiamo continuato questo lavoro in un moscerino della frutta. Queste mosche contengono la versione mutante del gene umano che causa la malattia di Huntington e mostrano molti sintomi tipici della malattia. Questo modello può essere utilizzato per capire sia i meccanismi della malattia, nonché per individuare strategie terapeutiche” ha proseguito. Il gruppo di Giorgini ha bloccato l’azione della KMO con due metodi diversi: con approcci genetici per spegnere il gene (gene knockout) e utilizzando farmaci che inibiscono l’attività di questo enzima, e in entrambi i casi è stata osservata una riduzione della neurodegenerazione in queste mosche.
A differenza dei lieviti, le Drosophile hanno un sistema nervoso e questo è stato un passaggio obbligato, per studiare e cercare di bloccare il processo che porta alla degradazione dei neuroni.
La ricerca di Giorgini arriva in contemporanea a quella pubblicata sulla rivista Cell (a cui ha partecipato anche il genetista di Leicester).
“Paul Muchowski e i nostri collaboratori presso l’Istituto di Gladstone a San Francisco hanno sviluppato e testato un inibitore della KMO, il JM6, in due modelli animali di topi che riproducono la malattia di Huntington o il morbo di Alzheimer, osservando una riduzione dei sintomi delle due malattie”.
Nei topi che riproducono la malattia di Alzheimer il nuovo composto ha ridotto il deficit di memoria e la perdita delle connessioni sinaptiche tra le cellule cerebrali, mentre nel modello di malattia di Huntington, JM6 ha impedito l’infiammazione del cervello e la perdita delle connessioni sinaptiche tra le cellule cerebrali, con un conseguente allungamento della sopravvivenza dell’animale.
Sorprendentemente, il JM6 non passa la barriera emato-encefalica e non penetra quindi nel cervello, ma agisce inibendo la KMO nel sangue. Le cellule del sangue inviano però un segnale di protezione al cervello, per stabilizzare la funzione delle cellule cerebrali e prevenire la neurodegenerazione. Quest’aspetto del trattamento faciliterà i test nei pazienti, visto che l’effetto del JM6 potrebbe essere confermata con un semplice esame del sangue.
“Il passo successivo sarà senz’altro quello di testare il JM6 con dei trial clinici e anche di sviluppare altri inibitori della KMO per aumentare la probabilità di trovare un composto che funziona efficacemente negli esseri umani”, conclude Giorgini.