Affrontare l’Alzheimer? Un solo approccio non basta
Se vogliamo aumentare le probabilità di successo per prevenire e combattere la malattia di Alzheimer, dobbiamo combinare diverse strategie. Abbiamo intervistato Patrizia Giannoni, ricercatrice di Pistoia che lavora all'Università di Nîmes, in Francia.
RICERCANDO ALL’ESTERO – La malattia di Alzheimer è stata identificata per la prima volta più di 100 anni fa e anche se la ricerca ha rivelato molti aspetti biologici della patologia, le cause sono ancora sconosciute e attualmente non esiste una cura adeguata.
Patrizia Giannoni si occupa di Alzheimer dal 2009, prima alla New York University, poi all’Istituto di Genomica Funzionale di Montpellier e attualmente presso l’Università di Nîmes.
L’obiettivo del suo lavoro è cercare di affrontare la patologia da varie prospettive, mettendo assieme diversi approcci, per aumentare la probabilità di successo non solo di una terapia ma soprattutto di una diagnosi precoce.
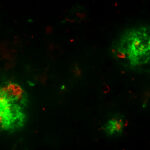
A livello molecolare, l’Alzheimer è caratterizzato da un accumulo di proteina beta amiloide e di ammassi neurofibrillari nel cervello, accompagnati da una reazione infiammatoria.
È possibile inibire la sintesi della proteina beta amiloide?
Questa proteina deriva da un precursore chiamato APP (Amiloid Precursor Protein) che viene tagliato da diversi enzimi: in base agli enzimi attivati si possono generare vari tipi di frammenti con funzioni cerebrali diverse.
Per esempio, i recettori accoppiati alle proteine G possono attivare delle secretasi che, invece di rilasciare la beta amiloide, portano alla produzione di sAPPα, un peptide neuroprotettivo. A Montpellier ho studiato un particolare tipo di recettori accoppiati a proteine G, chiamati 5HT4, attivati dalla serotonina e coinvolti nella trasmissione sinaptica. Tali recettori stimolano la via non amiloidogenica e rappresentano un’interessante strategia terapeutica contro la tossicità della beta amiloide.
Per cercare di inibire la sintesi di questo peptide, abbiamo testato una serie di agonisti o agonisti parziali dei recettori 5HT4 su topi transgenici 5XFAD, così chiamati perché esprimono cinque diverse mutazioni ritrovate in casi familiari di Alzheimer. I topi 5XFAD rappresentano un modello di Alzheimer piuttosto aggressivo perché sviluppano i primi sintomi molto più velocemente rispetto ai modelli che riproducono il decorso fisiologico della malattia. Il vantaggio è che possiamo vedere gli effetti di un farmaco in un tempo breve.
I dati raccolti mostrano che alcuni agonisti di 5HT4 sono effettivamente in grado di rallentare l’accumulo di amiloide a livello cerebrale e potrebbero essere usati a livello preventivo.
Esistono biomarker per l’Alzheimer?
Ci sono diverse molecole al centro degli studi dei ricercatori. È stato dimostrato che alcune alterazioni del cervello si riconoscono già 20 anni prima dei sintomi dell’Alzheimer. Ora l’obiettivo è riuscire a individuare biomarker sicuri nel sangue piuttosto che nel liquido cefalorachidiano, e magari trovarli in anticipo sullo sviluppo della malattia in modo da avere una finestra di azione più ampia.
Le persone indicate come particolarmente a rischio potrebbero essere trattate con agonisti 5HT4 o altre molecole MTDL (multi-target-directed ligands), cioè composti che non agiscono su un solo obiettivo ma su vari fronti contemporaneamente.
In collaborazione con l’Università di Caen (Francia) abbiamo studiato una molecola MTDL chiamata donecopride, nome che deriva dal Donepezil, uno dei principali farmaci usati per combattere l’Alzheimer. Donecopride è innovativo perché ha una duplice azione: è un agonista parziale dei recettori 5HT4, quindi riduce la sintesi di proteina beta amiloide e sembra inibire l’aggregazione dei peptidi beta in oligomeri tossici; e inibisce l’acetilcolinesterasi, enzima che degrada l’acetilcolina, neurotrasmettitore coinvolto nella memoria e apprendimento.
I risultati che abbiamo ottenuto in vitro e in vivo, soprattutto a livello cognitivo, sono molto promettenti.
Quali danni sono associati all’accumulo di beta amiloide?
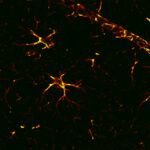
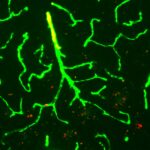
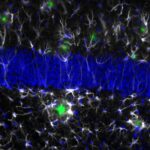
Nel mio lavoro mi sono occupata di studiare le alterazioni cerebrovascolari in relazione all’Alzheimer. Abbiamo visto che i danni sono sia a livello della barriera ematoencefalica sia delle cellule gliali; la barriera sembra avere dei buchi vicino ai quali si localizzano astrociti e neuroglia, espressi in quantità eccessiva e in forma attivata. Attorno ai vasi sanguigni, inoltre, si formano delle specie di depositi amiloidi, anelli di proteina beta tipici dell’angiopatia amiloide. Infine, i periciti – cellule murali che fanno parte dell’unità neurovascolare, regolano la contrazione dei vasi e contribuiscono all’integrità della barriera ematoencefalica – vanno prima incontro a ipertrofia e successivamente a degradazione e riarrangiamento.
Il ruolo vascolare è sicuramente fondamentale nello sviluppo dell’Alzheimer, il dubbio che rimane è se sia nato prima l’uovo o la gallina: in altre parole, sono i danni a carico della barriera ematoencefalica che provocano l’Alzheimer oppure è lo sviluppo dell’Alzheimer a determinare il danno alla barriera? La questione è difficile da risolvere.
Un argomento molto caldo al momento è il coinvolgimento del microbioma nella malattia di Alzheimer. Che legame c’è tra intestino e cervello?
Fino a poco tempo fa si pensava che il cervello fosse un organo a sé stante, quasi separato dal resto del corpo. In realtà abbiamo visto che comunica con tutti gli altri organi molto più di quello che ci si aspettava, e l’intestino è uno dei suoi interlocutori: si parla di gut-brain axis, una via di segnalazione biochimica che può passare attraverso il nervo vago, o la circolazione periferica, o per altre strade. Per esempio, la comunicazione potrebbe avvenire tramite una barriera ematoencefalica danneggiata, più permissiva nei confronti dei metaboliti e magari anche dei batteri.
Recentemente ho fatto una serie di esperimenti trasferendo il microbioma di topi con Alzheimer in topi sani: abbiamo visto che, in questi ultimi, le performance cognitive peggiorano e ci sono alterazioni a livello comportamentale. Un collegamento diretto tra specifici batteri che colonizzano l’intestino e l’Alzheimer sembra, dunque, essere davvero possibile. Certo, il microbioma dei topi non è quello umano, senza contare che ciascuno di noi ha una flora intestinale batterica diversa, ma per grandi famiglie e grandi percentuali ci assomigliamo, quindi questi studi sono promettenti.
Quali sono le prospettive future del tuo lavoro?
L’idea di legare il microbioma alle neuroscienze mi interessa molto, soprattutto i suoi cambiamenti in associazione a vari danni, come tossine o altri prodotti chimici. Non mi riferisco solo al microbioma intestinale, ma anche a quello delle vie aeree, della pelle e così via.
L’applicazione futura che vedo più plausibile riguarda la prevenzione, e quindi i probiotici e i prebiotici. A livello di terapia, il problema degli antibiotici è che la loro azione non è selettiva.
Avere, o rendere, un microbioma così efficiente da proteggerci da infezioni, malattie o da tutti quei fattori complessi che contribuiscono allo sviluppo di patologie come l’Alzheimer sarebbe davvero un sogno.
 Nome: Patrizia Giannoni
Nome: Patrizia Giannoni
Età: 37 anni
Nata a: Pistoia
Vivo a: Nîmes (Francia)
Dottorato in: farmacologia e tossicologia (Firenze)
Ricerca: Approcci multitarget nella prevenzione di malattie neurodegenerative
Istituto: gruppo CHROME, Université de Nîmes (Francia)
Interessi: sono appassionata di trail running, zumba, musica
Di Nîmes mi piace: le boulangeries, la posizione geografica tra mare, montagna e città da visitare
Di Nîmes non mi piace: il troppo traffico cittadino
Pensiero: E la vita lo sai, non è comoda per nessuno. Quando vuoi gustare fino in fondo tutto il suo profumo, devi rischiare la notte, il vino e la malinconia. (Francesco De Gregori, Caterina)
Leggi anche: Il sangue del cordone ombelicale per rallentare l’invecchiamento del cervello
Pubblicato con licenza Creative Commons Attribuzione-Non opere derivate 2.5 Italia.