Nanoparticelle cyborg
Una ricerca dell'IIT e dell'Università di Padova ha mostrato che nanoparticelle sintetiche sono capaci di comportarsi come proteine. È la prima volta che si osserva un fenomeno di questo tipo e la scoperta promette di avere importanti applicazioni di tipo medico.
APPROFONDIMENTO – Elementi organici e sintetici sembrano separati da un abisso. La fantascienza ha però esplorato da tempo la possibilità di organismi formati da un’unione di elementi organici e artificiali, i cosiddetti cyborg, dalle parole inglesi cybernetic organism. Negli ultimi decenni gli sviluppi tecnologici hanno permesso la costruzione di strumenti sempre più sofisticati come pacemaker, protesi o organi artificiali che si avvicinano molto a questo tipo di immaginario. Si tratta però di strumenti artificiali non organici che mimano a livello puramente meccanico alcune funzioni organiche. Può però un oggetto artificiale avere le stesse funzioni di uno organico? La risposta è arrivata oggi: nanoparticelle che funzionano come proteine. La scoperta tutta italiana si è guadagnata la copertina della rivista Chem, una delle pubblicazioni più importanti del settore. Lo studio, che ha importanti prospettive nell’ambito della medicina personalizzata, è stato prodotto dalla collaborazione del gruppo di ricerca di Molecular Modeling & Drug Discovery di IIT –Istituto Italiano di Tecnologia, guidato da Marco De Vivo con i gruppi di ricerca dell’Università di Padova guidati da Fabrizio Mancin e Federico Rastrelli.
Abbiamo intervistato Marco De Vivo per capire meglio le implicazioni e le possibili ricadute di questa scoperta.
Lei è direttore del laboratorio di Molecular Modeling & Drug Discovery. Ci spiega di che tipo di ricerche si occupa?
Le nostre linee di ricerca si focalizzano sull’uso dei computer e dei supercomputer per simulare quello che avviene a livello atomico nel funzionamento delle proteine o quando i farmaci si legano a queste ultime. Nel caso specifico dello studio di cui parliamo, abbiamo fatto lo stesso tipo di simulazioni sul comportamento delle nanoparticelle.
La ricerca che è uscita su Chem riguarda appunto l’uso delle nanoparticelle in medicina. Ci può spiegare cosa avete scoperto a riguardo?
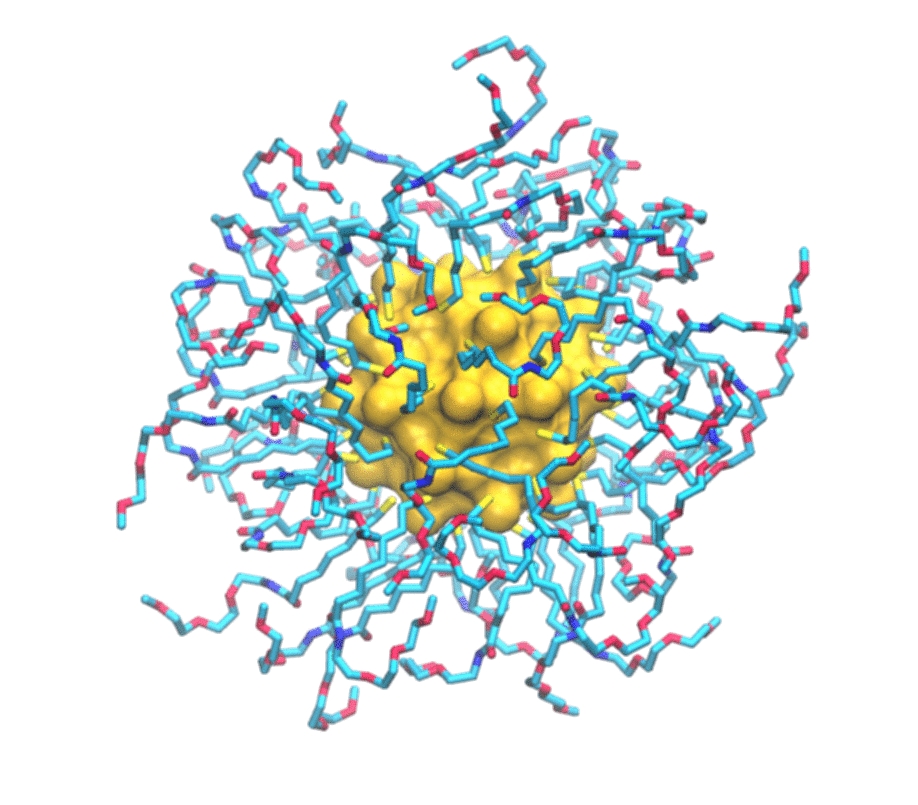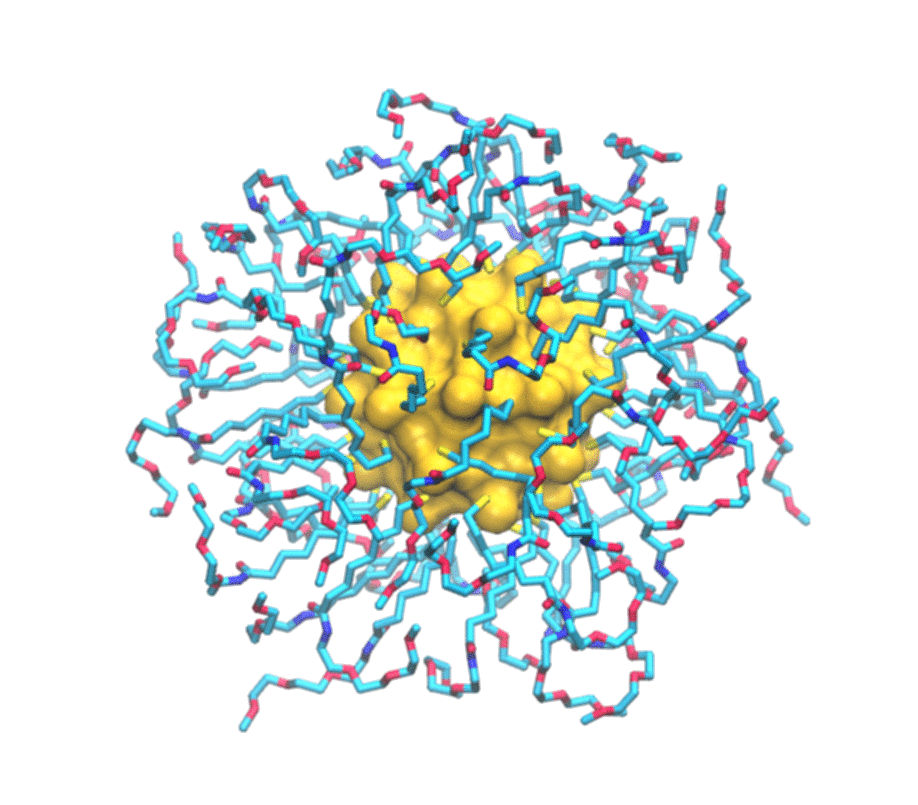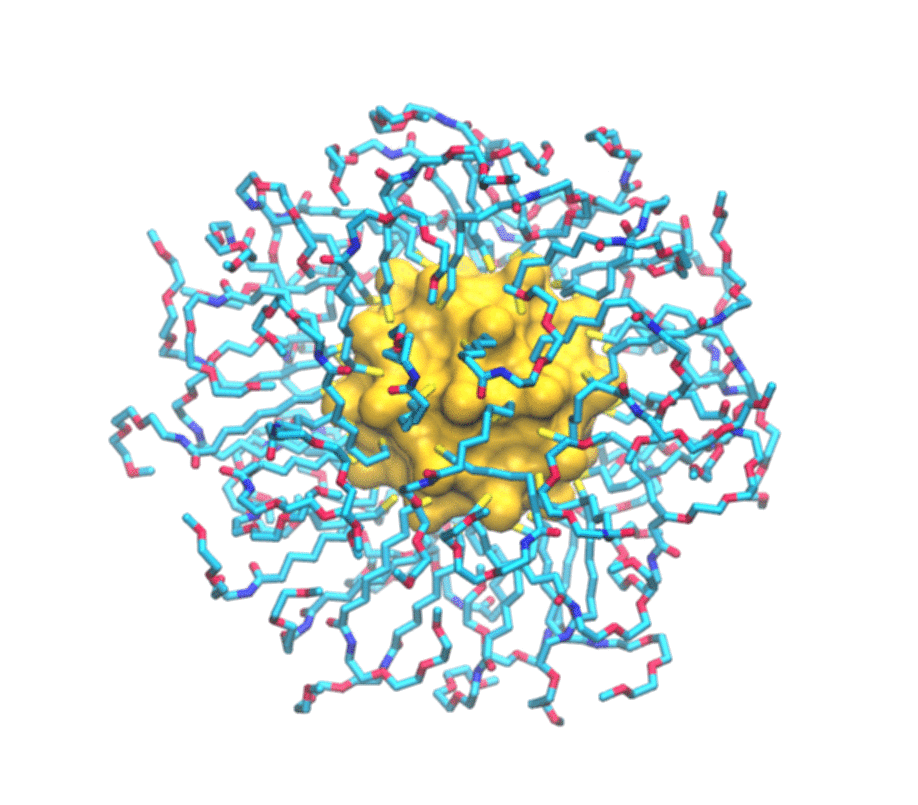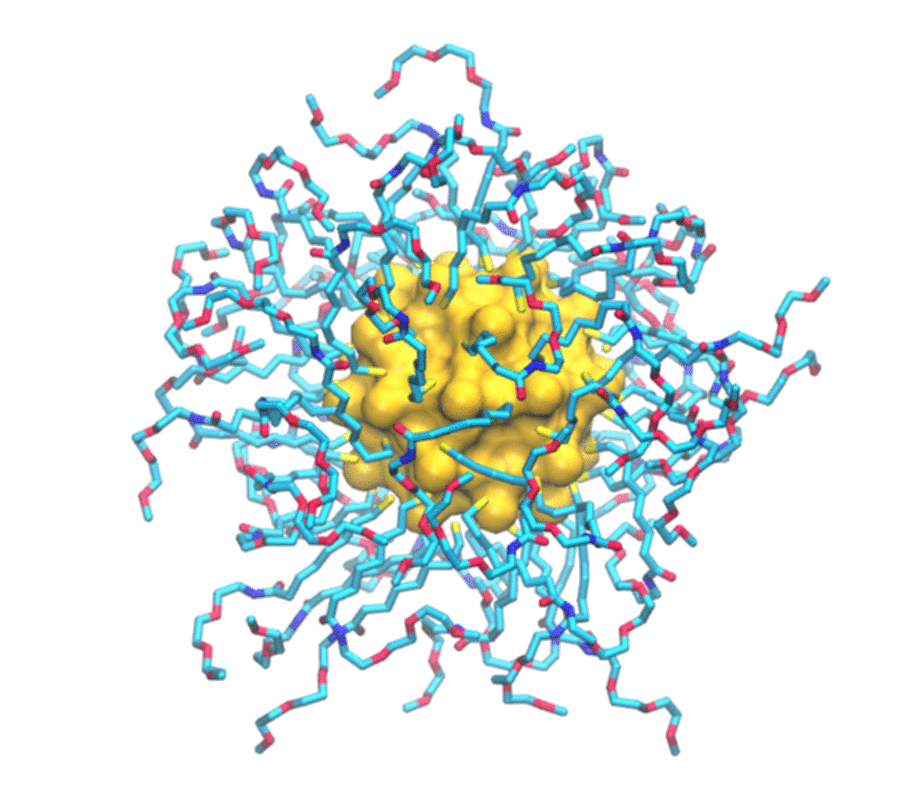
È uno studio combinato, sia teorico che sperimentale. Del primo aspetto si è occupato il mio laboratorio del secondo, invece, il gruppo del professor Mancin e del professor Rastrelli che sono dell’università di Padova. Loro realizzano un particolare tipo di nanoparticelle e ne studiano le caratteristiche utilizzando la risonanza magnetica nucleare. Si tratta in particolare di nanoparticelle formate da un nucleo d’oro e circondate da un guscio di molecole più piccole. Una serie di esperimenti hanno permesso loro già tempo fa di scoprire che queste nanoparticelle sono in grado di legarsi a sostanze presenti in soluzione. In particolare hanno osservato che ogni tipo di nanoparticella si attacca in maniera selettiva ad alcune delle piccole molecole presenti in soluzione e non ad altre. Perché questo avvenisse però non era chiaro. Stiamo parlando di oggetti dell’ordine del miliardesimo di metro, quindi molto piccoli, e i principi che regolano il funzionamento di questi materiali artificiali – non sono cose che esistono in natura – non era ancora stato previsto.
All’IIT attraverso simulazioni di dinamica molecolare su supercomputer ci siamo occupati appunto di prevedere il comportamento di queste nanoparticelle in diversi solventi in presenza di vari analiti, dove l’analita è la piccola molecola presente in soluzione. Quello che abbiamo visto e interpretato grazie alla parte sperimentale, che è sempre andata di pari passo con gli studi teorici, è che il riconoscimento tra nanoparticella e analita avviene secondo gli stessi principi che regolano il funzionamento delle proteine che riconoscono le piccole molecole dentro la cellula. Questo è proprio il cuore delle nostra scoperta: non era assolutamente scontato e né tanto meno eravamo a conoscenza che un oggetto artificiale potesse arrivare a fare quello che fa un oggetto organico nel nostro corpo
Questo è il parallelismo che ha permesso al nostro studio di avere l’attenzione che ha avuto da parte della rivista scientifica, un parallelismo che suggerisce che oggetti artificiali sono in grado di funzionare come oggetti organici. Quali sono le implicazioni di questo lavoro? Il punto cruciale è che delle nanoparticelle ancora sappiamo molto poco, mentre le proteine invece le conosciamo bene. Quindi ora sapere che queste nanoparticelle si comportano come delle proteine ci permette di utilizzare tecniche di design e di funzionalizzazione che si utilizzano già su queste ultime. L’idea che si apre ora è di utilizzare queste procedure per ottimizzare le strutture delle nanoparticelle in modo da ottenere un riconoscimento più specifico e selettivo di quelle piccole molecole che vogliamo trovare.
A questo proposito, ci descriva meglio queste nanoparticelle. Come sono fatte e come vengono costruite?
Per immaginarle si può pensare al Sole circondato da raggi: un nucleo d’oro che ha una funzione strutturale circondato da molecole più piccole attaccate attorno. Vengono prodotte in laboratorio con strategie di sintesi di chimica organica e metallo- organica, cioè si costruisce prima il nucleo e poi ci si possono attaccare le piccole molecole che formano i raggi.
E la struttura esterna di queste nanoparticelle esattamente di cosa è fatta?
Di molecole di carbonio organiche: tecnicamente sono alchili, cioè catene di carbonio, ossigeno e azoto che vengono attaccate al nucleo d’oro. Ovviamente in base alla loro struttura chimica hanno diverse proprietà ed è proprio questo strato esterno che dà alla nanoparticella una sua particolare funzione. Qual è il grosso passo che si può fare ora? Attualmente le nanoparticelle vengono fatte in modo empirico, cioè prima le si produce e poi si vede se funzionano o meno. Questo è quello che si faceva, sempre per rimanere nel parallelismo con le molecole organiche, con le proteine e i farmaci tanti anni fa: i farmaci si facevano in modo empirico, cioè si provavano e si sperava funzionassero. Poi è arrivata la comprensione dei principi che regolano il funzionamento dei farmaci e con questa è arrivato anche il loro disegno razionale. Vogliamo fare la stessa cosa: ora che abbiamo compreso i principi che regolano l’interazione tra nanoparticelle e analiti si potrà ingegnerizzare la nanoparticella e velocizzare la sua ottimizzazione. Questo permetterà anche di abbassare i costi, perché non ne dovrò più produrre a caso secondo la vecchia tecnica prove-ed-errori che ho spiegato prima, ma potremo lavorare in modo molto più mirato.
Si parla di un possibile utilizzo futuro nella medicina personalizzata, ma vi sono anche applicazioni più immediate.
Ecco, un possibile utilizzo è quello che hai accennato di un contributo allo sviluppo di una medicina personalizzata, ma per questo manca ancora molto tempo. Per rimanere più vicini un possibile utilizzo è nel campo della diagnostica del cancro. Vi sono particolari molecole che sono indicatori della presenza di determinate forme di cancro. La concentrazione di questi marcatori nel sangue è però estremamente bassa e difficile da rilevare, rendendo molto difficile una diagnosi. Grazie all’utilizzo di queste nanoparticelle è però possibile evidenziare la presenza di determinate sostanze in un campione di sangue. Questa nuova tecnica analitica che stiamo sviluppando un domani potrà essere utilizzata perciò per fare riconoscimento selettivo di marcatori di un cancro piuttosto che di un altro. La tecnica si può però applicare anche all’analisi di altri tipi sostanze, come quelle dopanti o stupefacenti.
Chiariamo bene il funzionamento. Se in un campione sono presenti per esempio i marcatori di un tumore, se si inseriscono in soluzione delle nanoparticelle specifiche, queste dovrebbero legarsi a questi marcatori. Però a quel punto come si fa a capire che questo è effettivamente avvenuto?
Si usano delle tecniche di analisi specifiche. Nel caso dello studio che abbiamo fatto, per esempio, la formazione di un legame tra nanoparticella e marcatore crea un segnale che viene letto attraverso la risonanza magnetica nucleare. Questo avviene perché gli analiti – nel nostro esempio i marcatori tumorali – nel legarsi si magnetizzano, producendo una determinata emissione di energia. Se la osservi nell’analisi, puoi dire che si è verificato un legame tra una nanoparticella e un analita. E nello specifico, a seconda del segnale, puoi anche conoscere che tipo di analita si è legato.
Visto che queste nanoparticelle possono funzionare in modo analogo alle proteine, sono possibili interazioni impreviste qualora dovessero entrare in circolo nell’organismo?
Non si prevede di iniettare nel corpo queste specifiche nanoparticelle, anche perché il nucleo di metallo potrebbe sollevare una serie di conseguenze, potenzialmente problematiche. Quindi non è così immediato il passaggio all’uso nel corpo umano, e per questo si pensa a un utilizzo solo in analisi di campioni. In senso più ampio le nanoparticelle però vengono pensate anche per utilizzi terapeutici di altra natura. Si parla ad esempio di nanoparticelle che fanno trasporto di farmaci, però è una applicazione diversa. Non è lo stesso utilizzo di cui ti ho accennato prima, e si tratta di nanoparticelle di diverso tipo.
La scoperta che avete fatto pone le basi teoriche per questo nuovo campo di ricerca. Il prossimo passo quale sarà?
Il prossimo passo è cercare di usare i metodi computazionali, di cui il mio laboratorio si occupa, per guidare il design di nanoparticelle molto più efficienti che possano riconoscere più sostanze, anche a concentrazioni molto basse. In seguito potremo portare questa tecnologia a produzione, speriamo nel futuro prossimo. Attualmente il nostro lavoro è consistito nel dimostrare che si può fare, che è la parte più complicata. Ora bisogna farlo e ci stiamo già lavorando, sempre in collaborazione con il gruppo di Padova. Nanoparticelle che siano più efficienti e che vadano a riconoscere esattamente le sostanze a cui siamo interessati. Tutto quello che potresti andare a cercare in un campione di sangue di un paziente.
Leggi anche: Nanoparticelle “appiccicose”: una nuova strategia contro il cancro
Pubblicato con licenza Creative Commons Attribuzione-Non opere derivate 2.5 Italia. ![]()