 SALUTE – «Noi siamo abituati a raccontare storie, ma forse questa è la storia più bella che abbiamo raccontato finora» afferma Francesca Pasinelli, direttore generale di Telethon. Una storia che riguarda Mohammad, Giovanni, Kamal, Samuel – unico italiano fra i sei – Canalp e Jacob. Sei piccoli pazienti affetti da due gravi malattie genetiche – la leucodistrofia metacromatica (la stessa malattia della piccola Sofia del caso Stamina) e la sindrome di Wiskott-Aldrich – che tre anni fa hanno iniziato il trattamento con una terapia genica innovativa e che ora mostrano significativi benefici e stanno bene.
SALUTE – «Noi siamo abituati a raccontare storie, ma forse questa è la storia più bella che abbiamo raccontato finora» afferma Francesca Pasinelli, direttore generale di Telethon. Una storia che riguarda Mohammad, Giovanni, Kamal, Samuel – unico italiano fra i sei – Canalp e Jacob. Sei piccoli pazienti affetti da due gravi malattie genetiche – la leucodistrofia metacromatica (la stessa malattia della piccola Sofia del caso Stamina) e la sindrome di Wiskott-Aldrich – che tre anni fa hanno iniziato il trattamento con una terapia genica innovativa e che ora mostrano significativi benefici e stanno bene.
La terapia, che sfrutta il virus dell’Hiv, nasce dell’intuizione di uno scienziato italiano, Luigi Nandini, direttore dell’Istituto San Raffaele Telethon per la terapia genica (Tiget), che nel 1996 aveva trovato il modo di renderlo innocuo e sfruttarlo per veicolare materiale genetico. Oggi quell’idea, portata avanti dai ricercatori del Tiget guidati dallo stesso Nandini e sostenuta da Telethon con 19 milioni di euro, quasi sicuramente si è trasformata in una terapia per queste due gravi patologie e apre le porte alla cura di altre malattie genetiche, anche più diffuse. «A tre anni dall’inizio della sperimentazione clinica i risultati ottenuti sui primi sei pazienti sono davvero incoraggianti: la terapia risulta non solo sicura, ma soprattutto efficace e in grado di cambiare la storia clinica di queste gravi malattie. Dopo 15 anni di sforzi, successi in laboratorio, ma anche frustrazioni è davvero emozionante poter dare una prima risposta concreta ai pazienti» spiega il direttore del Tiget. Il riconoscimento per il lavoro svolto dall’équipe di Nandini arriva anche a livello internazionale con una doppia pubblicazione sulla rivista Science.
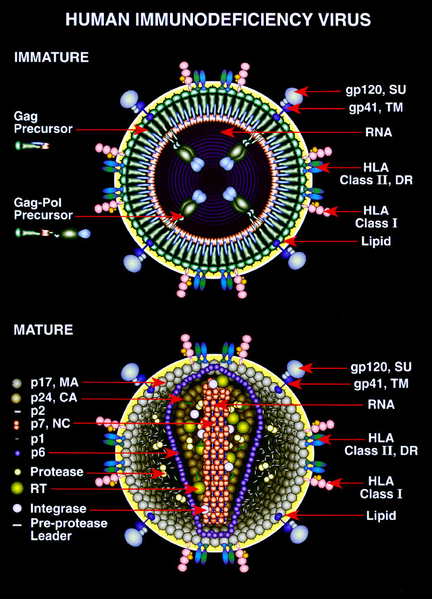
Il protagonista di questa storia è anche il vettore virale derivato dall’Hiv, detto “lentivirale”, che mantiene solo il 10% del virus originario ma conserva la sua capacità di introdursi nelle cellule e trasferirvi materiale genetico. Il virus quindi funziona come un cavallo di Troia che trasporta all’interno delle cellule difettose il materiale genetico in grado di correggere il problema. Un unico approccio per due malattie diverse. La leucotrofia metacromatica infatti è una malattia neurodegenerativa dovuta al deficit di un enzima, l’Arsa, responsabile dello smaltimento di alcune sostanze come i sulfatidi. Quando l’enzima non c’è o funziona male queste sostanze si accumulano nel sistema nervoso e danneggiano in maniera irreversibile la mielina, il rivestimento dei nervi. La conseguenza è una perdita graduale delle capacità motorie e cognitive acquisite fino a quel momento. La sindrome di Wiskott-Aldrich invece è sempre causata dalla carenza di una proteina (WASp) per colpa di un gene difettoso (Was) ma riguarda il sistema immunitario. Questa carenza infatti si ripercuote sulla struttura e il funzionamento delle cellule del sistema immunitario e delle piastrine, che espone i bambini – sono colpiti solo i bambini maschi con una frequenza di uno su un milione – a infezioni ricorrenti, emorragie anche fatali e un maggior rischio di riscontrare malattie autoimmuni o tumori.
La tecnica sviluppata dai ricercatori del Tiget consiste nel prelevare le cellule staminali ematopoietiche dal midollo del paziente stesso ed esporle al lentivirus che al suo interno trasporta una copia corretta del gene responsabile della malattia. Una volta “infettate” le cellule staminali inglobano il materiale genetico corretto e vengono re-infuse nell’organismo. In questo modo sono in grado di ripristinare la proteina mancante e correggere il difetto. «Nella sindrome di Wiskott-Aldrich le cellule del sangue sono direttamente colpite dalla malattia e le cellule staminali corrette sostituiscono quelle malate» spiega Alessandro Aiuti che ha coordinato lo studio clinico su questi pazienti. «Nel caso della Leucodistrofia metacromatica invece – chiarisce Alessandra Biffi, a capo dello studio su questa malattia – il meccanismo terapeutico è più sofisticato: le cellule modificate viaggiano attraverso il circolo sanguigno fino a raggiungere il cervello dove rilasciano la proteina corretta che viene “raccolta” dalla cellule nervose circostanti. In questo caso ciò che ha fatto la differenza è stato ingegnerizzare le cellule in modo da produrre una quantità di proteina molto superiore al normale per contrastare il processo neurodegenerativo».
Per ora sono stati resi noti i risultati di soli tre pazienti per ciascuno studio, perché solo per questi era passato un tempo sufficientemente lungo dall’inizio della terapia per confermarne sicurezza ed efficacia. Gli studi però hanno visto il coinvolgimento di sedici pazienti in totale, sei per la sindrome di Wiskott-Aldrich e dieci per la leucodistrofia metacromatica.
«Questo traguardo è un esempio di come la ricerca condotta con rigore, determinazione e dedizione possa portare ai risultati sperati – ha affermato durante la conferenza stampa Maria Grazia Roncarolo direttore scientifico dell’Irccs Ospedale San Raffaele che aveva preso parte all’avvio dello studio sulla sindrome di Wiskott-Aldrich – la ricerca traslazionale ha tempi lunghi, a volte accettati con fatica dai pazienti e i genitori, ma non possiamo esimerci dall’eseguire tutti i passaggi necessari. Possiamo diventare più efficienti e ridurre i tempi fino a un certo punto, ma per la sicurezza stessa dei pazienti non è possibile saltare alcuna tappa».
I lavori sono stati dedicati a tutti i bambini che in questi dieci anni non ce l’hanno fatta e a tutte le famiglie coinvolte, ha ricordato Nandini durante la conferenza stampa. «Dieci anni di speranza – ha affermato Alessandra Biffi in un video del 2010 proiettato durante la conferenza stampa – in cui noi stavamo sempre indietro rispetto alla malattia e durante i quali abbiamo perso tanti bambini. Ora trattare il primo bambino con questa terapia è un’emozione unica». La speranza ora è che qualche industria farmaceutica – come la Glaxo che ha firmato una partnership con il Tiget – trasformi questa terapia in farmaco ad ampia diffusione.
Crediti immagine: Drs. Louis E. Henderson and Larry Arthur. NIH 1994, Wikimedia Commons





